综述 | 病理性瘢痕的发生机制及治疗新进展

基金项目:
国家自然科学基金(名称:自体乳糜脂肪移植抑制增生性瘢痕的作用及机制,编号:81772085)
通信作者:
陈敏亮,军总医院第四医学中心烧伤整形医学部副主任,主任医师,教授,博士生导师;主要研究方向为组织损伤的修复重建,瘢痕的防治,微创注射美容并发症及脂肪移植的基础与临床研究,医学美容相关并发症的治疗。DOI:10.15909/j.cnki.cn61-1347/r.005005
病理性瘢痕是一类纤维增生异常疾病,可以发生在烧伤、创伤、手术甚至是蚊虫叮咬之后,其发病率和患病率极高,是整形领域的常见疾病。对于患者而言,烧伤后的瘢痕挛缩、畸形、功能障碍以及伴随的痛痒症状才是阻碍其重返社会、树立生活信心的最大障碍。因此,研究病理性瘢痕的发病机制和防治方法不仅对患者有着重要意义,也有重大的社会价值。本文对近年来有关病理性瘢痕发病机制和防治的研究进展综述如下。
01
病理性瘢痕发病机制的研究现状
近年来,关于病理性瘢痕发病机制的研究大多集中于参与创伤修复过程的蛋白质、细胞因子和相关信号通路等方面,在正常情况下,这些因子在修复过程的各个阶段作用于不同的效应细胞,起着促进或抑制纤维增生作用,从而使细胞外基质的合成和降解趋于平衡,不会引起病理性瘢痕的产生,但在某些情况下,如内环境的改变等,可能会引起某些因子含量增多和(或)某些因子的含量减少,细胞外基质合成和降解的平衡被打破,瘢痕体积增加,病理性瘢痕形成。
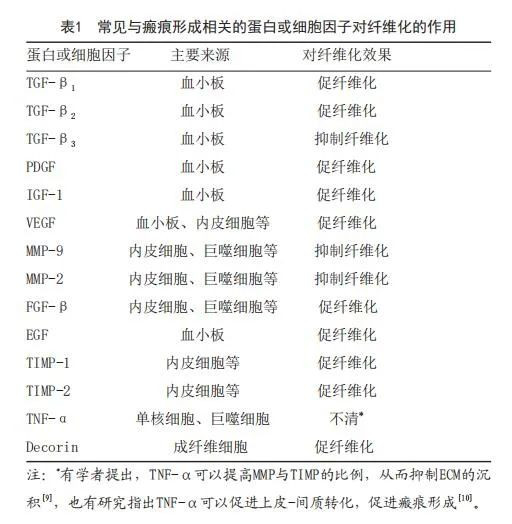
1.1 创伤愈合相关因子在病理性瘢痕发病中的作用:创伤愈合过程分为炎症期、增殖期和重塑期,过程复杂且相互交错,许多蛋白和细胞因子在创伤愈合过程中各自或协同发挥作用。了解各种细胞因子的功能对病理性瘢痕的防治有着重要作用。目前研究证实,与病理性瘢痕形成关系密切的蛋白、细胞因子、信号通路有TGF-β/Smad信号通路及相关蛋白,转化生长因子β(Transforming growth factor β,TGF-β)、PI3K/AKT信号通路、血小板源性生长因子(Platelet-derived growth factor,PDGF)、 胰岛素样生长因子1(Insulin-like growth factor- 1 , I G F - 1 ) 、 表 皮 生 长 因 子 ( E p i d e r m a l g r o w t h factor,EGF)、血管内皮生长因子(Vascular endothelial g r o w t h f a c t o r , V E G F)、基质金属蛋白酶( M a t r i x metalloproteinases,MMPs)、金属蛋白酶组织拮抗剂 (Tissue inhibitors of metalloproteinases,TIMPs)、白介素(Interleukin,IL)、成纤维细胞生长因子(Fibroblast growth factor,FGF)、肿瘤坏死因子α(Tumor necrosis factor-α,TNF-α)和核心蛋白聚糖(Decorin)等。见表1。病理性瘢痕的发病机制错综复杂,随着研究的深入,定会有越来越多与之相关的蛋白、基因等被发现,通过对这些蛋白的调控也可能对病理性瘢痕的防治有一定的作用,这仍需研究者进一步探索。
1.2 氧化应激可能参与病理性瘢痕形成:氧化应激(Oxidative stress,OS)是1985年Helmut提出的,是指机体的活性氧(Reactive oxygen species,ROS)产生过多和/或抗氧化能力降低,导致活性氧及其相关产物大量聚集,并对某些分子或细胞产生毒性作用的病理状态。ROS可以损伤DNA,导致DNA双链结构破坏,损伤蛋白质,导致某些氨基酸或肽链被氧化,现已证实氧化应激参与许多疾病的发生。细胞的正常代谢过程可以产生少量的ROS,机体固有的抗氧化机制可以有效清除ROS,避免过多的ROS对机体造成损害,核因子红细胞2相关因子2(Nuclear factor erythroid 2-related factor 2,Nrf2)是目前研究发现的最核心的抗氧化应激信号蛋白,它可以调控许多抗氧化物质和凋亡有关蛋白的表达,如:过氧化氢酶、血红素加氧酶、谷胱甘肽等,还可以调控凋亡相关蛋白Bcl2的表达。近年有许多研究表明氧化应激与病理性瘢痕的形成有关。
许多研究证明氧化应激相关通路和蛋白在正常皮肤组织和病理性瘢痕组织中表达有差异。李伟等测定了正常皮肤与病理性瘢痕细胞中铜锌超氧化物歧化酶(CuZnsuperoxide dismutase,CuZn-SOD)含量及活力,结果显示同正常皮肤组相比,增生性瘢痕和瘢痕疙瘩组的CuZn-SOD 含量及活力均明显升高,差异有统计学意义(P<0.05),但增生性瘢痕和瘢痕疙瘩组间差异无统计学意义。D e Felice等检测了人正常组织、增生性瘢痕和瘢痕疙瘩成纤维细胞(Keloid fibroblast,KF)中活性氧的含量,发现后两者的含量均高于前者(P<0.05)。Lee等发现KF中的Nrf2含量明显低于正常组织,且细胞中氧化的产物2,4-二硝基苯肼的含量明显升高,用SiRNA敲除成纤维细胞Nrf2基因后,细胞生长明显被抑制,且凋亡被激活,他们还发现KF中的Bcl2表达相较于正常组织成纤维细胞下调。2019年,Carney等建立红杜洛克猪伤口的动物模型,并检测了伤口愈合过程中谷胱甘肽、超氧化物歧化酶等25种抗氧化应激物质的含量与相应的基因表达量,结果发现,与对照组相比,所有蛋白的含量与基因表达均减少,说明病理性瘢痕形成过程中ROS和抗氧化物质平衡被打破,并以此提出了保持内源性ROS和ROS清除剂的平衡可以抑制病理性瘢痕的形成。除此之外,氧化应激的相关通路也与许多纤维化通路有直接联系。有研究表明Nrf2的激活可以通过PI3K/Akt信号通路减轻上皮间质转化,从而抑制病理性瘢痕的形成。还有研究证明某些蛋白可通过影响Keap1/Nrf2/ARE抗氧化途径来调节TGF-β1蛋白的表达,说明Nrf2可能会直接影响TGF-β/Smad通路。
综上,氧化应激与病理性瘢痕的形成有重要关系,但具体机制尚不清楚,能否通过抗氧化作用来防止病理性瘢痕形成仍需大量研究证实。
1.3 MicroRNA在病理性瘢痕形成中的作用:MicroRNA(miRNA)是一类长约20个核苷酸的非编码RNA,可以通过与mRNA结合而阻断mRNA翻译或使mRNA降解,以此调控细胞增殖、分化等过程。有大量研究表明miRNA与病理性瘢痕的形成相关,为今后预防病理性瘢痕提供了新的思路。
2016年,Luan等收集并检测9例瘢痕疙瘩患者和7名正常人的血清样本,发现有37个差异表达的miRNA,其中17个表达上调,20个表达下调;Yao等收集了正常皮肤和瘢痕疙瘩组织样本,检测了其中miRNA的表达,发现有46个miRNA上调,而28个miRNA下调,深入研究后发现miR-1224-5p可能通过TGF-β/Smad3通路抑制KF的增殖和迁移,促进其凋亡;QI等发现增生性瘢痕中的miRNA-26a表达下调,过表达miRNA-26a可以通过抑制TGF-β/Smad通路中的Smad2蛋白表达减少细胞外基质形成,从而抑制瘢痕形成;Pang等发现瘢痕疙瘩细胞中的microRNA-152-5p表达较正常皮肤成纤维细胞下调,他们还发现smad3蛋白是microRNA-152-5p靶向蛋白,过表达microRNA-152- 5p可以通过抑制smad3蛋白抑制成纤维细胞的增殖和迁移并促进凋亡;Li等研究发现增生性瘢痕成纤维细胞(Hypertrophic scar fibroblast,HSF)中的miRNA-21表达升高,他们还证明了miRNA-21可以通过抑制TGF-β/Smad通路中的Smad7蛋白从而减少细胞外基质的生成;还有文献表明miRNA-21的过表达可以通过PI3K/AKT信号通路促进HSF的增殖。Guo等的研究发现miRNA-29b不仅可以促进创伤修复,还可以通过抑制TGF-β/Smad通路而减轻瘢痕形成。An等发现miRNA-205可以通过抑制KF中VEGF表达以抑制PI3K/AKT通路,从而拮抗瘢痕疙瘩的产生。
miRNA调节信号转导的功能十分强大,既往研究表明TGF-β/Smad通路和PI3K/AKT通路与HSF和KF的增殖、凋亡和细胞外基质生成关系密切,寻找更多可以调节它们的miRNA或将成为未来治疗病理性瘢痕的重要研究方向之一。
1.4 上皮间质转化可能参与病理性瘢痕形成:上皮间质转化(Epithelial-mesenchymal transition,EMT)是指上皮细胞在某些因素的作用下改变生物学性状转化为间充质细胞的病理生理学过程。其特征是上皮细胞的极性、形态和表型改变,逐渐转变为间充质细胞。研究证实EMT与纤维化和创伤愈合等进程有关,尤其在调控细胞外基质沉积、重新上皮化等方面。现有研究认为EMT过度激活使上皮细胞源源不断地向成纤维细胞或肌成纤维细胞转化,最终导致细胞外基质过度沉积,可能是病理性瘢痕形成的原因之一。
常见的上皮细胞标志物为角蛋白(Keratin)、钙黏蛋白E(E-cadherin)等,而间充质细胞标志物为钙黏蛋白N(N-cadherin)、波形蛋白(Vimentin)和成纤维细胞特异性蛋白1(Fibroblast‐specific protein-1,FSP1)等,Yan等研究发现相对于正常组织,瘢痕疙瘩表皮层增厚,且含有波形蛋白和FSP1单阳性细胞,进一步研究发现EMT与局部炎症因子TNF-α含量升高相关,并提出EMT与瘢痕疙瘩的发生有密切联系。Li等应用免疫组化检测了瘢痕疙瘩表皮层、皮肤附属器和微血管中EMT标志物的表达,结果显示钙黏蛋白E减少,FSP1、波形蛋白等表达明显增加,他们还将人毛囊外鞘和表皮角质形成细胞在体外应用TGF-β1诱导培养后发现钙黏蛋白E表达下降,且波形蛋白和FSP1表达明显升高。2016年,Kuwahara等在用TNF-α和TGF-β1培养正常皮肤角质形成细胞后也发现细胞逐渐变成纺锤状,相关蛋白也发生了同样的变化。由此可见,EMT与 TGF-β/Smad信号通路息息相关,更与病理性瘢痕的形成有关,现阶段的研究大多停留在体外实验,尚需要更多体内实验来证实其联系。
02
自体脂肪及其来源的间充质干细胞在病理性瘢痕防治领域的应用
手术切除是瘢痕疙瘩治疗的一线措施,但其存在的最大问题就是复发,因此,防止复发也是治疗的关键。2018年发表的“中国瘢痕疙瘩临床治疗推荐指南”给出的建议为“手术切除结合综合治疗防止复发”,临床上在术后广泛采用的放疗、化疗、激素、激光和各种新型减张措施已有效降低了瘢痕疙瘩的复发率。
现有治疗手段还有激光、冷冻治疗等,治疗效果不一,且都有副作用待解决。随着对病理性瘢痕的研究增多,科研工作者在不断改进旧的治疗手段的同时也发掘了一批新的防治方法,尤其是对于自体脂肪移植及其来源间充质干细胞的研究,为病理性瘢痕的防治打开了一扇新的大门。本文主要阐述自体脂肪及其来源的间充质干细胞对病理性瘢痕防治作用的研究进展。
2.1 脂肪来源间充质干细胞预防病理性瘢痕的探索:脂肪来源间充质干细胞(Adipose derived mensenchymal stemcell,ADSC)是来源于脂肪组织的具有多项分化潜能的干细胞,其在再生医学中的应用增多,许多学者都对其进行了深入研究,发现其在预防增生性瘢痕也有一定的作用。
2015年,Zhang等将12只新西兰白兔随机平均分为三组,在兔耳上制造创面,并收集兔腹部脂肪提取ADSC, 所有模型在兔耳瘢痕形成前于右耳注射DMEM作为对照,左耳分别注射等量的ADSC、脂肪来源干细胞条件培养基(Adipose derived stem cell condition medium,ADSCCM)和不处理,3周后发现,注射了ADSC和ADSC-CM的兔耳均未发展为增生性瘢痕,而未处理和右耳均形成了增生性瘢痕;随后,他们将瘢痕组织取下,检测了其中α-SMA和I型胶原(Collagen I)的含量,发现两者含量均低于未处理组和对照组,说明ADSC可以通过减少α-SMA和Collagen I的表达来预防增生性瘢痕形成。2017年,Foubert等在杜洛克猪皮肤上制造创面,提取猪ADSC,并给实验组注射ADSC,对照组不做处理,结果发现实验组较对照组少有增生性瘢痕形成,且组织内胶原含量少,排列整齐。还有学者将ADSC和HSF共培养后发现,HSF的增殖、迁移和分泌功能被抑制,原理可能与ADSC降低了HSF中的TGF-β1、 Notch-1的表达、抑制p38/MAPK通路等有关。
2.2 自体脂肪移植技术在治疗病理性瘢痕上的应用:自体脂肪移植是通过抽吸获取自体脂肪颗粒,再将其注射到自身软组织缺损部位,这项技术应用于整形外科领域仅十几年的历史。1995年,Coleman创造了一种可以大大提高脂肪抽吸和注射存活率的方法,称为Coleman法,它也作为脂肪抽吸技术的金标准沿用至今,自此,自体脂肪移植在整形外科领域的应用大大增多。2013年,Klinger应用自体颗粒脂肪松解了烧伤后胸部和口周的挛缩性瘢痕,避免了实行皮瓣覆盖等重建修复手术及相关并发症。有文献证明,颗粒脂肪可促进瘢痕胶原纤维再生并重新排列,也可刺激瘢痕内部毛细血管再生,对改善局部微循环有重要作用。
2013年,Patrick等认为将颗粒脂肪经过物理处理后得到的乳糜化脂肪有类似于ADSC的功效,他将这种脂肪称为纳米脂肪。他们随后检测了未处理的脂肪抽吸物和纳米脂肪中存活细胞的情况,发现纳米脂肪中无存活的脂肪细胞,但有大量的ADSC,将纳米脂肪应用到治疗瘢痕、下睑暗沉,6个月后发现瘢痕和下睑暗沉都有明显的改善。2018年,Xu等应用乳糜化脂肪移植治疗了80例增生性瘢痕患者,他们将获取的脂肪洗净,去除粗大的纤维组织,用0.8 mm纳米转换头连接两个注射器,将脂肪组织反复推注30次,得到乳糜化脂肪,均匀注射到增生性瘢痕组织内,隔3个月治疗一次,共3次,经过3年的随访观察,有67例患者效果明显,8例有效,5例无效,2例患者部分复发。病理结果显示,治疗后的增生性瘢痕组织胶原纤维厚度变薄,排列整齐,血管密度明显减少。2019年,Chen等在裸鼠背部移植增生性瘢痕,并用乳糜化脂肪注射后发现瘢痕组织明显缩小,瘢痕组织内核心蛋白聚糖的表达明显降低。此外,他们从乳糜化脂肪中提取ADSC,发现其有多向分化的潜能,与HSF共培养后发现ADSC可以抑制HSF的活性,包括增殖、迁移和产生胶原的能力。
综上,自体脂肪移植对于病理性瘢痕的治疗作用明显,而纳米脂肪相较于颗粒脂肪拥有更细微的结构,因此其顺应性好,注射阻力小,在临床上的应用前景更加广阔。
03
展 望
防控瘢痕的首要步骤即为“防”,在了解发病机制的基础上,用某些手段加速创伤愈合,或纠正可能造成病理性瘢痕的原因,使创伤愈合达到“无病理性瘢痕愈合”甚至“无瘢痕愈合”。传统观念认为瘢痕是创伤愈合的必然结果,当创伤愈合的炎症期、增殖期、重塑期都被完成,那么瘢痕必然形成。上个世纪就有国外学者的研究表明某些伤口可以无瘢痕愈合,说明瘢痕并不是创伤愈合的必然结果,研究无瘢痕愈合的机理将是未来的研究重点。病理性瘢痕主要是由于细胞外基质的过度沉积,而细胞外基质绝大部分是在增殖期产生,那么找寻方法使创伤愈合越过增殖期直接进入重塑期,或缩短增殖期的时间是否能预防病理性瘢痕也是一个值得深思的问题。此外,已有不少研究表明病理性瘢痕具有遗传性,若能从基因层面筛选易患病理性瘢痕的伤者,早期给予相应的预防措施,将为临床治疗提供极大的便利。随着对病理性瘢痕的研究越来越深入,其发病机制越来越明了,防治手段也越来越多,相信未来瘢痕的防治研究将会有更大的进展。
本文引用格式:
李仕一,陈敏亮.病理性瘢痕的发生机制及治疗新进展[J].中国美容医学,2022,31(4):169-173.
下载医美查APP
了解更多信息