从沉睡到觉醒,重组人源化胶原蛋白时代已来?
今年4月底,国家药监局综合司发布了关于《重组人源化胶原蛋白》医疗器械行业标准立项的通知,文件要求,采取快速程序开展标准制定,保证标准质量和水平。
根据《采用快速程序制定国家标准的管理规定》,快速程序是为了缩短标准制定周期,以适应企业对市场经济快速反应的需要。如果采取快速程序,意味着在正常标准制定程序的基础上,可以省略起草阶段,或省略起草阶段和征求意见阶段。
有关部门为何“着急”制定重组人源化胶原蛋白医疗器械行业标准?重组人源化胶原蛋白市场到底发生了哪些变化?
从沉睡到觉醒,重组胶原蛋白领域的政策沿革
有关部门对重组胶原蛋白领域的规范,早在2008年就出台了相关政策。不过时隔13年以后,也就是去年,对相关规定进行了调整。
2008年5月26日,国食药监械发布《关于胶原蛋白软骨载体等产品分类界定的通知》,其中明确“重组人脱细胞真皮基质:包含胶原蛋白、纤维粘连蛋白、层粘连蛋白等细胞外基质成分,通过临时性覆盖皮肤创面,保护并促进创面修复,用于断层或小面积全层皮肤缺损的修复。该产品作为Ⅲ类医疗器械管理。”

图片来源:国家药品监督管理局官网
随着市场与科学技术的技术,相关政策于13年后进行了部分调整。2021年4月15日,国家药监局发布了《国家药监局关于发布重组胶原蛋白类医疗产品分类界定原则的通告》,针对重组胶原蛋白类医疗产品管理属性和管理类别判定,其中文件第四条具体规定“重组胶原蛋白类产品作为无源植入物应用时,应当按照第三类医疗器械管理。”“重组胶原蛋白类产品作为医用敷料应用时,若产品可部分或者全部被人体吸收,或者用于慢性创面,按照第三类医疗器械管理;若产品不可被人体吸收且用于非慢性创面,按照第二类医疗器械管理。”改变了此前统一按照三类医疗器械管理的规定,给予市场更多活力。

图片来源:国家药品监督管理局官网
也是在去年,2021年3月15日,国家药监局还发布了另外一项规定,《重组胶原蛋白生物材料命名指导原则》将重组胶原蛋白分为重组人胶原蛋白、重组人源化胶原蛋白、重组类胶原蛋白三类。由于生物合成技术水平受限,目前市场上未出现重组人胶原蛋白,只有重组人源化胶原蛋白和重组类胶原蛋白两类产品。

图片来源:国家药品监督管理局官网
文件中将重组人源化胶原蛋白定义为由DNA重组技术制备的人胶原蛋白特定型别基因编码的全长或部分氨基酸序列片段,或是含人胶原蛋白功能片段的组合。其利用生物发酵技术实现可规模化生产,通过实验证实此胶原蛋白表达量大,水溶性好,生物活性高,其性能优于人天然胶原蛋白,在生物医用材料、美容化妆品、食品保健等领域有着广大的应用前景。
此后,就是今年4月,国家药监局综合司发布的关于《重组人源化胶原蛋白》医疗器械行业标准立项的通知,要求采取快速程序开展标准制定。这份文件的发布也标志着重组人源化胶原蛋白的标准规范工作正式提上日程。
首款重组人源化胶原蛋白产品获批,开启广阔市场空间
在医美行业中,由于重组人源化胶原蛋白的部分特性,其基础结构跟人体相同,含有大量的的亲水性基因,具有良好的成膜性,同时可以保持皮肤角质层水分。其可以用来引导上皮细胞快速进入受损部位,有效提高皮肤再生速度,缩短创伤愈合时间,从而恢复皮肤屏障功能。
在实际的产品应用中,市场上普通胶原蛋白产品例如双美旗下的“肤柔美”、“肤丽美”和“肤力原”,博泰旗下的“弗缦”,荷兰汉福旗下“爱贝芙”等。
而重组人源化胶原蛋白这一细分赛道,目前只有山西锦波生物医药股份有限公司的重组Ⅲ型人源化胶原蛋白冻干纤维获得了国家药监局的批准上市。
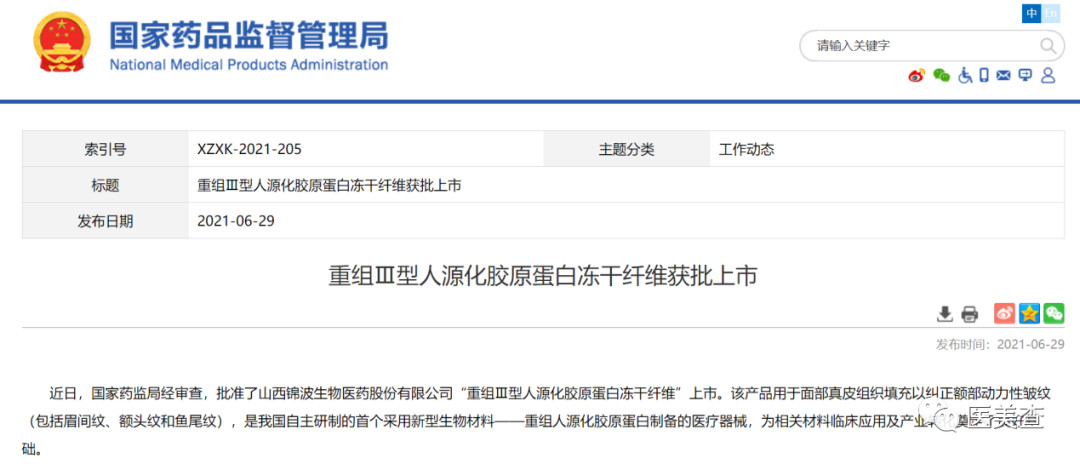
![]()
图片来源:国家药品监督管理局官网
2021年6月29日,锦波生物申请的“重组Ⅲ型人源化胶原蛋白冻干纤维”正式获得NMPA批准,成为国内第一款也是目前唯一一款重组人源化胶原蛋白。此产品适用于胶原蛋白注射、胶原蛋白填充泪沟、胶原蛋白丰泪沟、胶原蛋白淡化黑眼圈、胶原蛋白填充下颌缘、胶原蛋白填充下巴、胶原蛋白填充额头、胶原蛋白填充鼻子、全面部紧致提升、面部精修、胶原蛋白淡化面部细纹等多种项目。

图片来源:锦波生物公众号
据了解,重组Ⅲ型人源化胶原蛋白技术是由复旦-锦波功能蛋白联合研究中心、川大-锦波功能蛋白联合研究室、重医-锦波人源化胶原蛋白新材料临床研究中心历时14年持续攻关,获得的重大科研成果突破。该技术积累了我国诸多院士、科学家的智慧,成功攻破核心技术瓶颈,国际首次实现了人源化胶原蛋白产业化。
在传统胶原蛋白领域中,胶原蛋白主要是从动物组织中通过化工提纯而来,但此类胶原蛋白由于其提纯方式为异种提纯,作用于人体表现出水溶性差、不易与人体结合,皮肤涂抹易出现排异过敏反应的特征。
“人源化胶原蛋白”为解决此弊端提供了一个重要的发展方向,它将人体中天然胶原蛋白的全长或功能区基因序列组合,通过生物合成、蛋白纯化得到的胶原蛋白,其氨基酸序列应与人体天然胶原蛋白对应区域序列保持一致,不含非人体胶原蛋白序列,同时具有人体胶原蛋白的典型生物学功能和稳定的三螺旋结构的胶原蛋白,而重组Ⅲ型人源化胶原蛋白即是人源化胶原蛋白首例成功的案例。
国家药监局在公开发文中明确表示,“此次批准上市产品所使用重组Ⅲ型人源化胶原蛋白具有以下特点:一是其氨基酸序列的重复单元与人胶原蛋白氨基酸序列特定功能区相同,生物相容性好;二是其功能区域具有164.88°柔性三螺旋结构,相关结构数据已被国际蛋白结构数据库收录;三是其具有高于人体I型和Ⅲ型胶原蛋白的细胞粘附性,形成了网状纤维结构,具有良好的修复特性,预计在血管内皮、子宫内膜、创面、口腔黏膜修复及骨科等领域具有更广阔的临床应用。”
公开资料显示,目前锦波生物的重组Ⅲ型人源化胶原蛋白的产品线应用主要包含了护肤类的肌频和重源,以及医美类的薇旖美。这些产品对应了人源化III型胶原蛋白的不同功效,包括深层补水、紧致毛孔、人源修复和再生抗衰等。
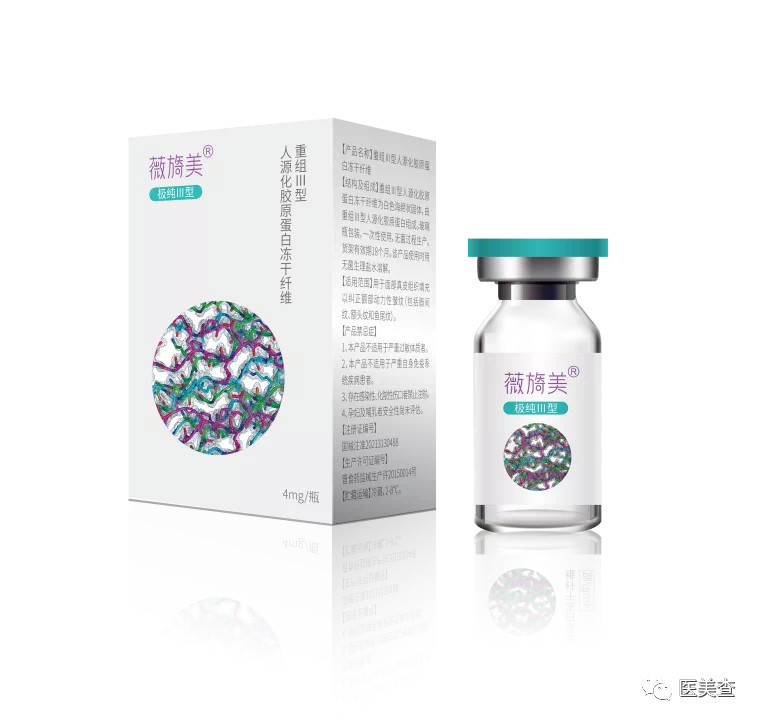
图片来源:锦波生物公众号
2022年1月29日,四川大学国家生物医学材料工程技术研究中心张兴栋院士团队在《Composites Part B》(影响因子:9.078)发表关于锦波生物重组Ⅲ型人源化胶原蛋白(rhCOL III)可用于制备新型人工心脏瓣膜脱细胞基质的重要研究成果。

![]()
图片来源:网络
在企业自研重组Ⅲ型人源化胶原蛋白之外,国外高端产品的引进工作也在持续不断地推进之中。
2021年12月21日,江苏吴中宣布投入1.66亿元,取得达透医疗51%的股权,以获得这家公司享有的一款韩国童颜针品牌AestheFill在中国境内的独家销售代理权。江苏吴中副总裁、吴中美学首席战略官CSO张帅鑫表示,公司接下来将尽快提交此产品的临床报告并推进相关产品的上市。
不同于医美市场最为主流的透明质酸钠产品,胶原蛋白产品赛道将更多专注于高端路线,更多有科研能力、研发实力的新玩家将逐步入局。
江苏吴中作为一家资深药企,除依靠进口产品之外,也在进行相关产品的自研工作。旗下中凯生物自行研发的重组胶原蛋白生物修复敷料产品利用重组Ⅲ型胶原蛋白,能够达到有效抚平细纹、抗衰祛皱的效果。2022年4月,江苏吴中与苏州纳生微电子有限公司签署战略合作框架协议,依托各自在纳米晶片,重组Ⅲ型胶原蛋白等领域的研发和生产能力,围绕医美高端医疗器械产品和透皮功能性护肤产品进行联合研发。
冲击资本市场
目前,胶原蛋白仍只是医美市场上一个规模较小的细分赛道,根据弗若斯特沙利文的资料,中国重组胶原蛋白产品市场规模2021年约为108亿元,但其增速高于全球平均水平,年复合增长率为63%。预计可以从2022年的185亿元增至2027年的1083亿元,预计未来年复合增长率为42.4%。
此赛道的主要玩家,仍是传统的重组类胶原蛋白领域企业。2022年5月5日,巨子生物向港交所递交招股书。招股书显示,2019年至2021年,巨子生物的营业收入分别为9.57亿元、11.91亿元和15.53亿元;净利润额分别为5.75亿元、8.27亿元和8.28亿元;净利润率分别为60.1%、69.4%及53.3%。巨子生物于2022年1月完成首轮融资。虽然此次融资金额并未公开,但投资方中出现高瓴、中金、CPE源峰、金镒、君联、景林、鼎晖、黑蚁等资本的身影。其中,高瓴持股比例为4.99%,为巨子生物最大的投资方.业内人测算,巨子生物此轮估值接近193亿元。
巨子生物的主营业务可分为皮肤护理产品和功能性食品及其他。其中,皮肤护理产品2021年实现营收15.03亿元,占巨子生物全年营收的比例为96.8%。有着可复美、可丽金、可预、可痕、可复平、利妍、欣苷、参苷等八大品牌。其中的可丽金、可复美更是胶原蛋白化妆品中的佼佼者,在各大电商平台的声量占比较高。
除巨子生物之外,前文提到的锦波生物,以及创尔生物,都已向资本市场发起冲击。2022年4月8日,锦波生物披露了北交所IPO方案,发行底价确定为117元,高于目前110.98元的股价。创尔生物则主攻传统动物源胶原蛋白,在闯关科创板失败后,也宣布转战北交所。
除初次冲击上市的企业之外,资深玩家也依靠胶原蛋白领域的新概念,推动了企业在资本市场的发展。5月中旬,江苏吴中医美相关产品自主研发的信息发布后,股票多次涨停。
对于市场层面的创新和应用,政策层面正在显示出更为积极的响应和规范举措,这些信号一方面透露了相关部门规范行业发展的决心,另一方面也体现了政策对创新产业发展的敏感度和支持力度。双重合力下,会开启一个胶原蛋白应用的新时代吗?
-END-
下载医美查APP
了解更多信息







