从新规看2022年医美行业监管重点
医美产业笔记导读:
“水光针”“射频仪器”监管级别的调整终于尘埃落定。(文末附《医疗器械分类目录》附件)
追溯到2021年4月,国家药品监督管理局医疗器械标准管理中心发布关于征求《射频美容类产品分类界定指导原则》(征求意见稿)意见的通知;再到2021年11月国家药品监督管理局医疗器械标准管理中心对外发布关于征求《医疗器械分类目录》(调整意见)的通知,直到2022年3月30日,《医疗器械分类》正式调整。
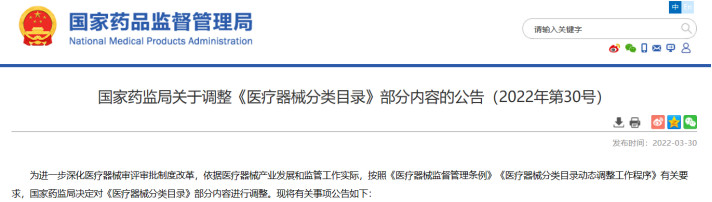
对于附件中调整涉及的09-07-02射频治疗(非消融)设备中射频治疗仪、射频皮肤治疗仪类产品,自本公告发布之日起,可按《医疗器械注册与备案管理办法》(国家市场监督管理总局令第47号)的规定申请注册。自2024年4月1日起,射频治疗仪、射频皮肤治疗仪类产品未依法取得医疗器械注册证不得生产、进口和销售。
也就是射频仪器是给了两年缓冲期的。
《公告》还提到:对于调整内容的其他产品,自本公告发布之日起,药品监督管理部门依据《医疗器械注册与备案管理办法》《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》等,按照调整后的类别受理医疗器械注册申请。
对于已受理尚未完成注册审批(包括首次注册和延续注册)的医疗器械,药品监督管理部门继续按照原受理类别审评审批,准予注册的,核发医疗器械注册证,并在注册证备注栏注明调整后的产品管理类别。
对于已注册的医疗器械,其管理类别由第三类调整为第二类的,医疗器械注册证在有效期内继续有效。如需延续的,注册人应当在医疗器械注册证有效期届满6个月前,按照改变后的类别向相应药品监督管理部门申请延续注册,准予延续注册的,按照调整后的产品管理类别核发医疗器械注册证。
也就是说,除射频仪器类的其他产品,都在《公告》发布的当天就开始执行;Ⅲ类变Ⅱ类是可以直接申请延续的,至于Ⅱ类变Ⅲ类,公告中虽然没有给出明确指示,但肯定是要“从头来过”,射频仪器是“Ⅱ类变Ⅲ类”中的一员,只不过“缓期两年执行”,其他的“立即执行”。
这些变动中我们关注比较多的就是水光针和射频仪器。
先看水光针。
水光针是一种“中胚层疗法”,注射部位多为真皮层浅层至中层,具有补水、保湿效果。从成分看,狭义上,水光针仅指纯HA制剂的基础水光;广义上或实际应用中,可分为四大类,包括纯HA制剂、富含多种营养素的HA制剂、以某一其他成分为主的制剂和协同多个成分的配方制剂。
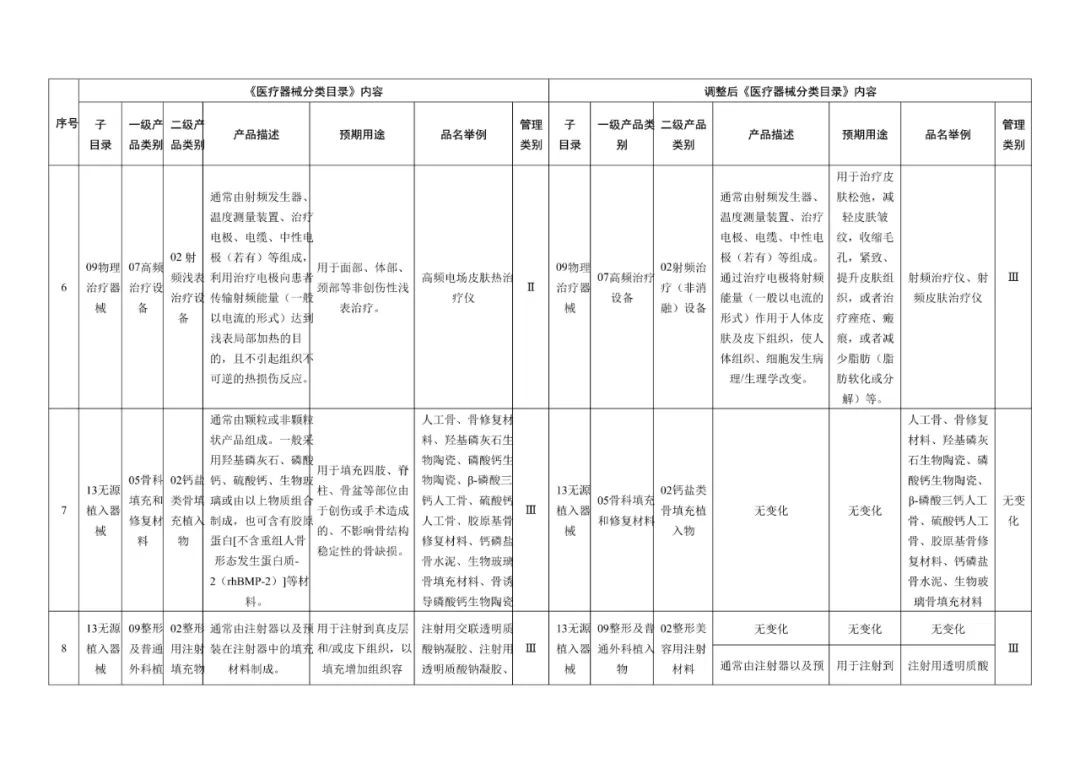
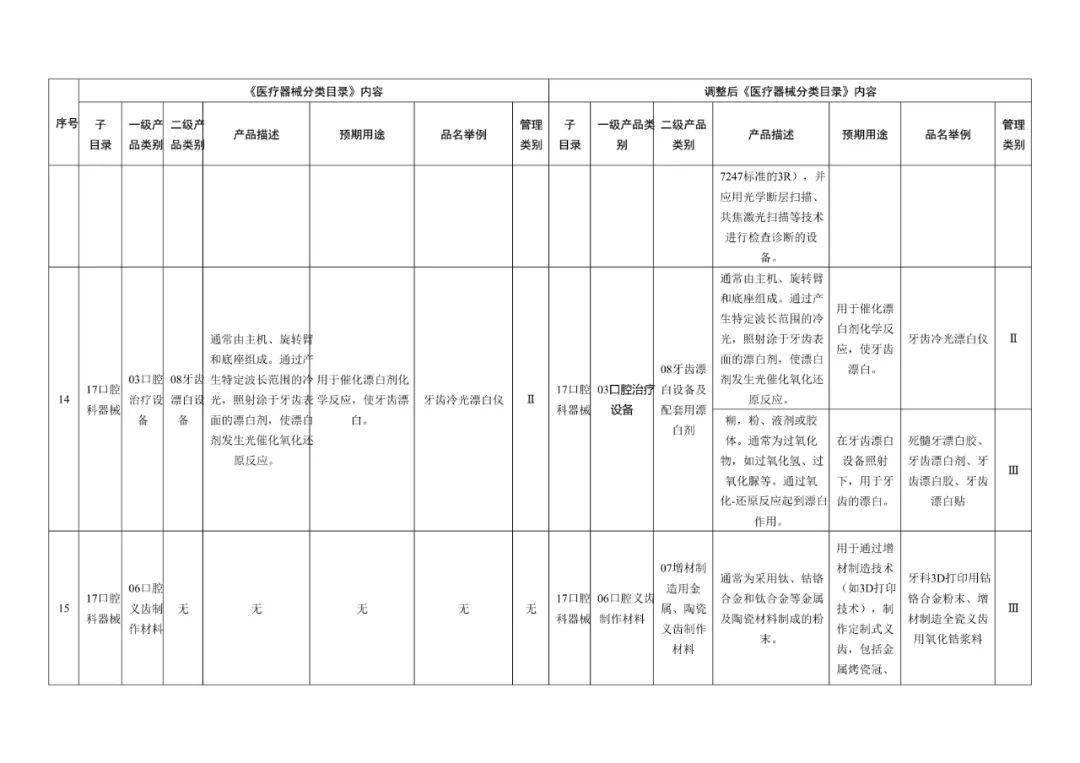
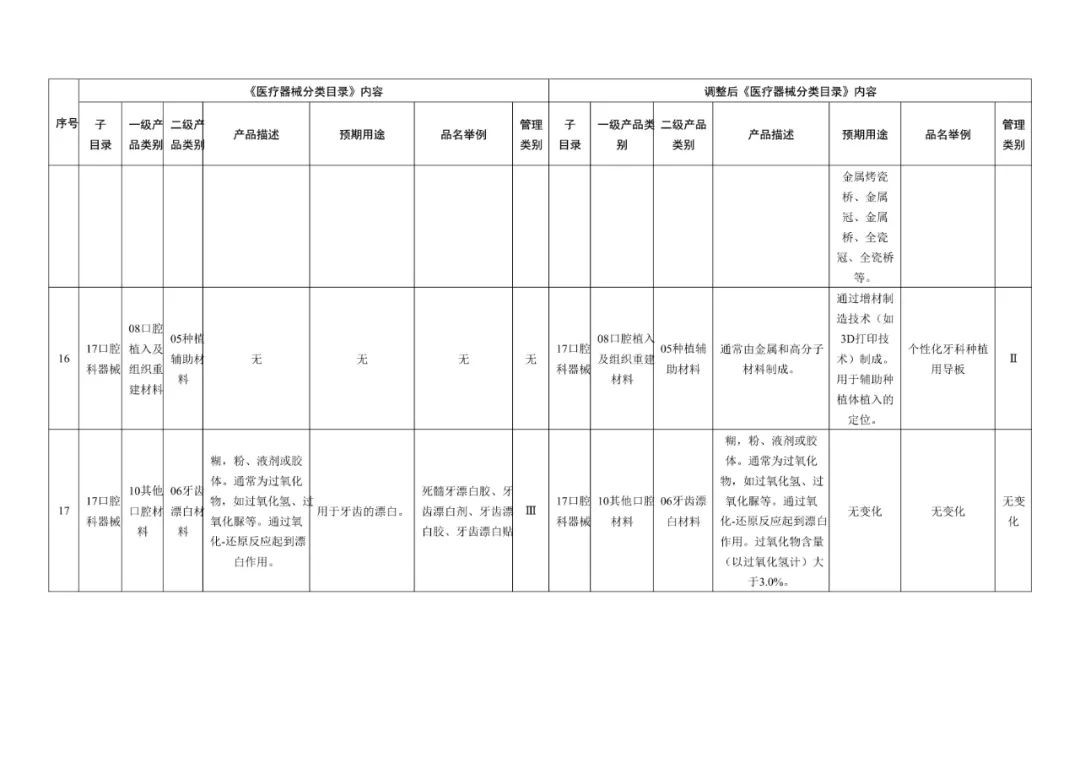
在调整后的《医疗器械分类目录》中,“无源植入器械”的产品描述由【通常由注射器以及预装在注射器中的填充材料制成】调整为【增加:通常由注射器以及预装在注射器中的材料(一般以透明质酸钠为主要成为组成,产品不应含有发挥药理学、免疫学或者代谢作用的成分)】;预期用途由【用于注射到真皮层和/或皮下组织以填充增加组织容积】调整为【增加:用于注射到真皮层主要通过所含透明质酸钠等材料的保湿、补水等作用,改善皮肤状态。】;“品名举例”中也增加了“注射用透明质酸钠溶液”。
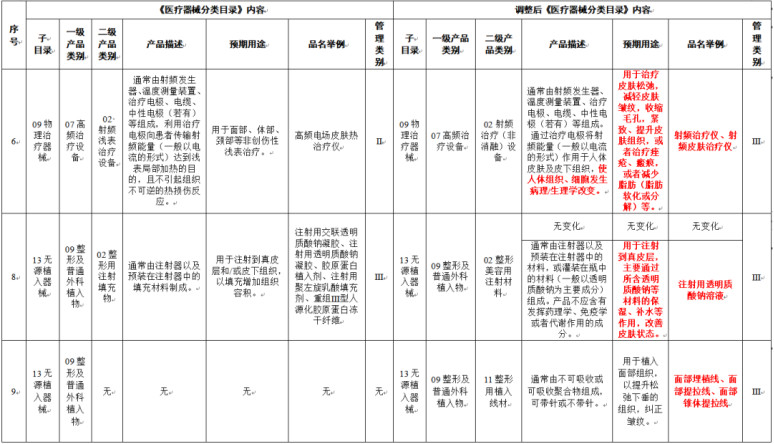
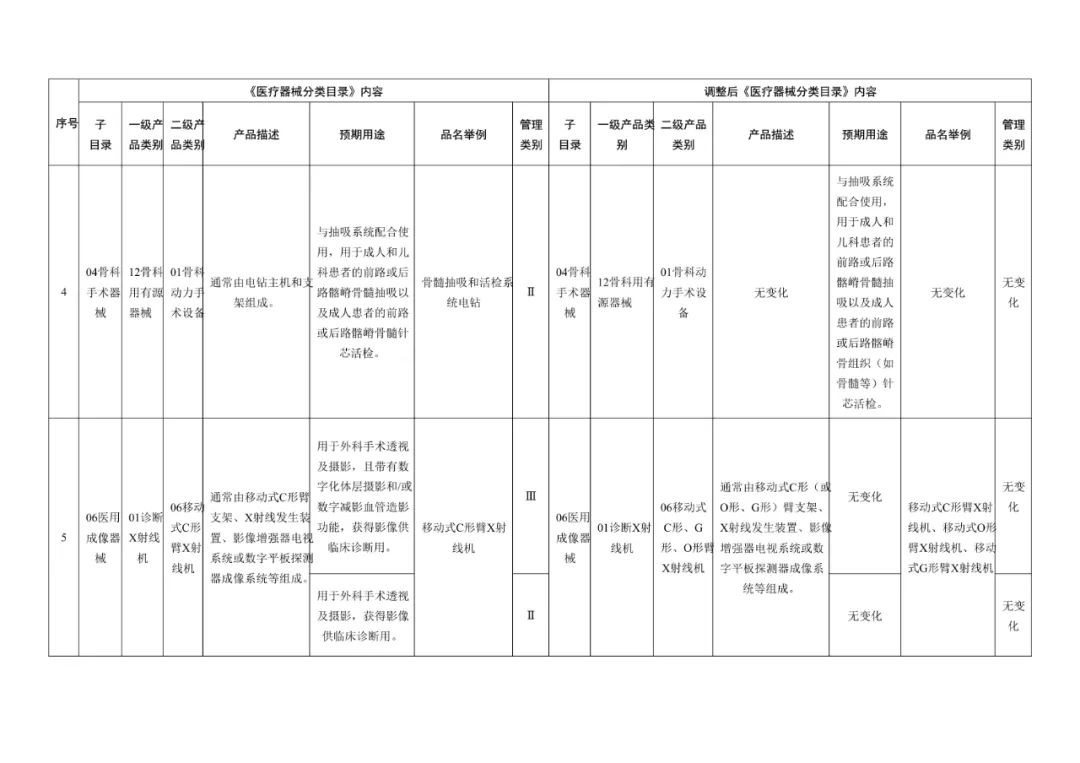
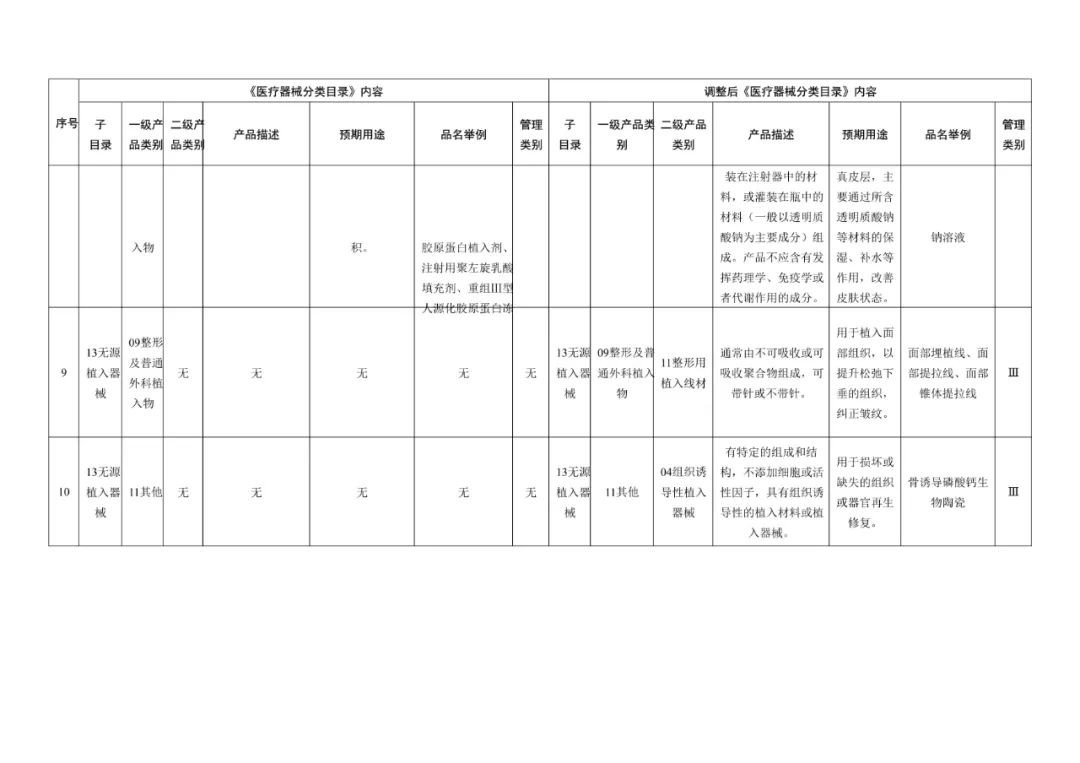
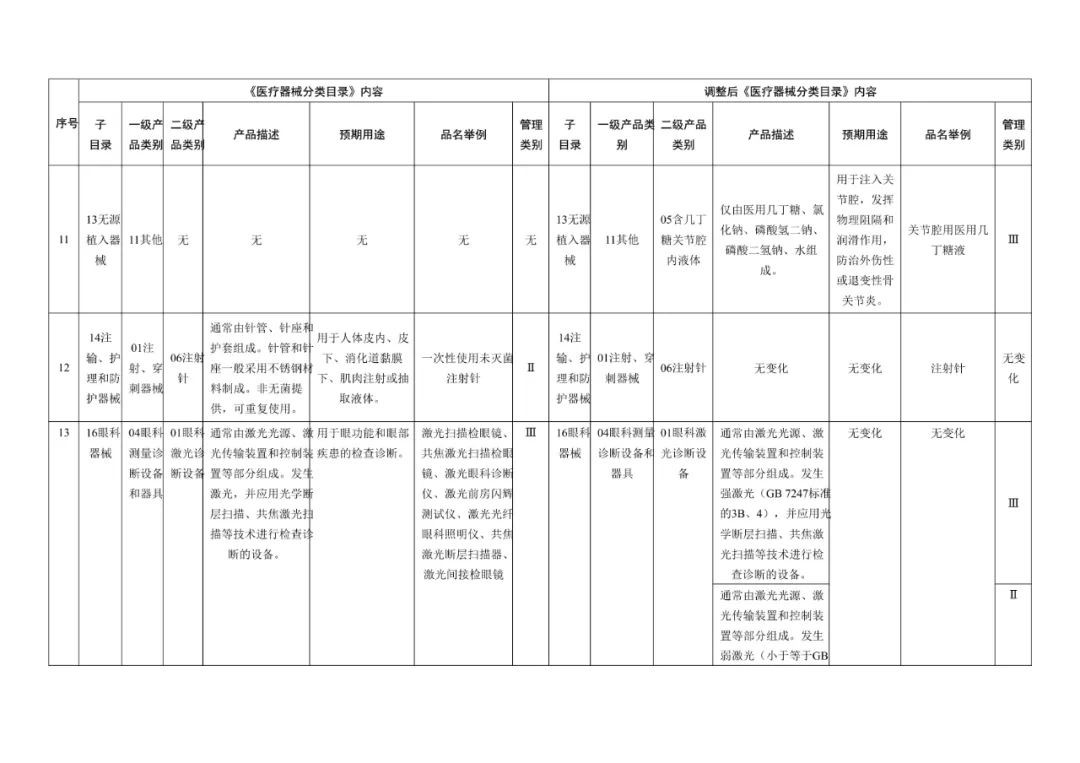
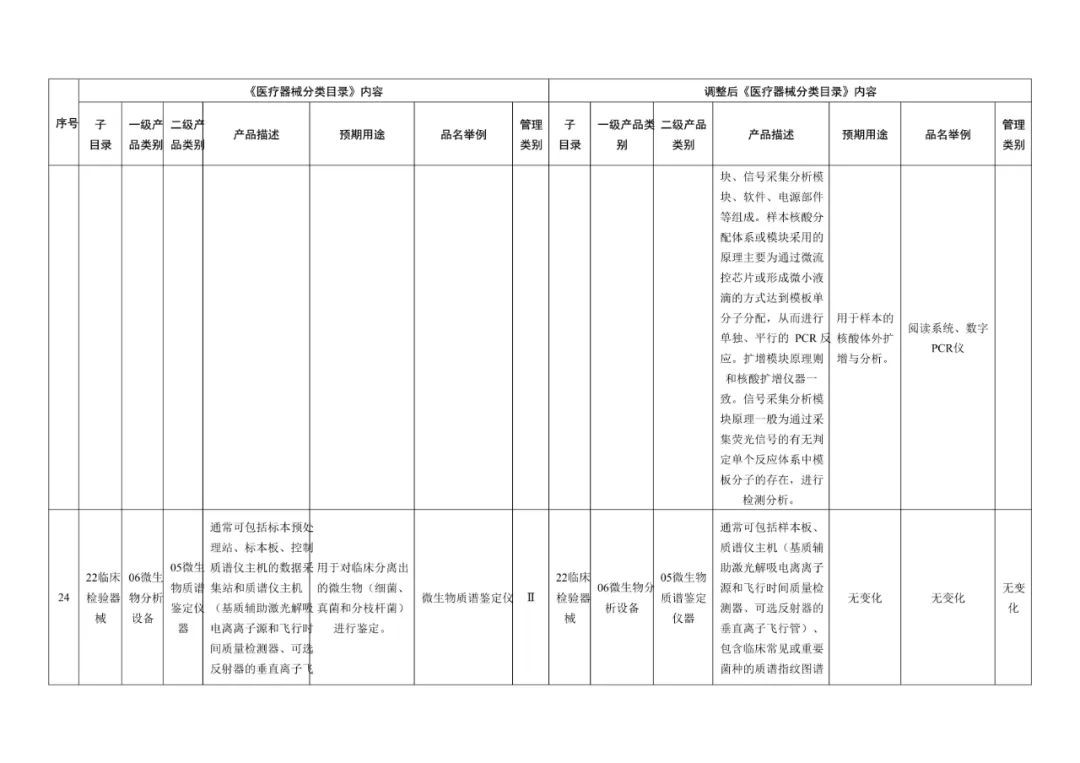
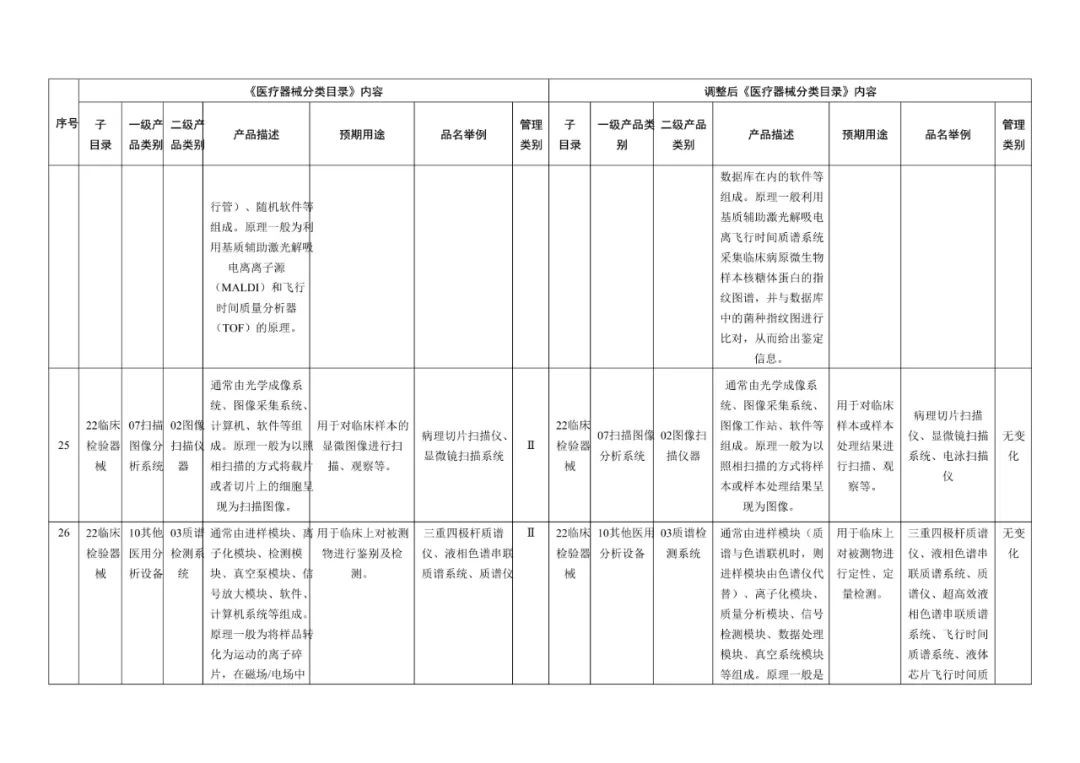
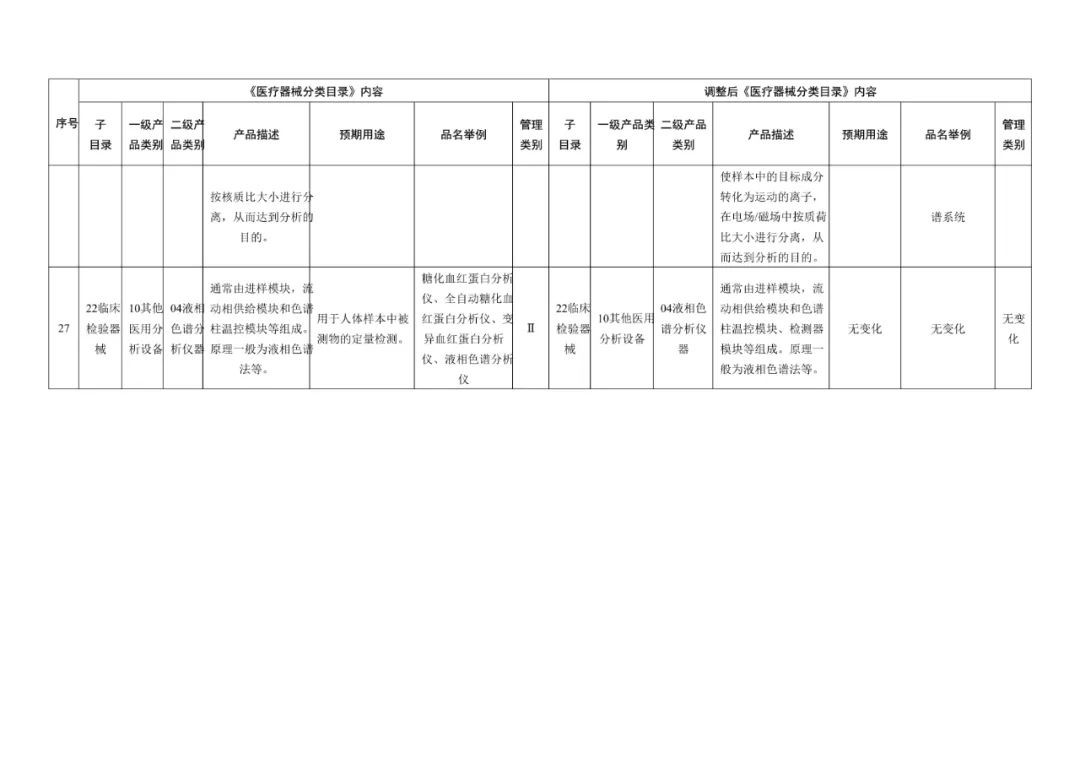
《医疗器械分类目录》部分内容调整表对部分医美产品监管类别做出调整
水光针一般包括注射类水光和微针类水光,即便是在调整之前作为破皮类注射项目,也应该先通过国家药品监督管理局的Ⅲ类医疗器械认证,才可以生产销售。
然而,现在的水光针市场并没有严格执行这个规定,一直存在着不同资质证明混用、适应症错用等乱象。比如,按照Ⅲ类器械注册但适用证不相关;Ⅱ类或Ⅰ类医疗器械,被部分机构当作Ⅲ类医疗器械使用;化妆品备案,也被部分机构当作针剂注射……
很重要的一个原因就是,此前药监局2017年的文件显示:整形时使用的注射用修饰透明质酸钠,当其预期用途为增加组织容积,应按照第三类医疗器械进行管理。而对于不是以增加组织容积为预期用途的注射整形美容产品,需按照其具体成分和主要作用机理判定是否属于医疗器械。简单的说,在之前的规定中,如果只是将保湿、补水作为预期用途的注射整形美容产品的话,则有可能不被认定为医疗器械,这也是水光针医械监管的漏洞之一。
在本次医疗器械分类目录调整中,注射用透明质酸钠溶液与时俱进地加入了“用于注射至面部真皮层,主要通过所含透明质酸钠等材料的保湿、补水等作用,改善皮肤状态”的新描述,针对水光针的监管补上了漏洞。
水光针的监管一直存在漏洞,这次在政策层面上的规范势必触动行业原本的格局。关于政策调整后正规水光针产品到底还有哪些,医美产业笔记此前曾做过分析。(详情:《“水光针”新规落地之后,目前所有“水光针”产品均不合规?》)
再看射频仪器。
子目录“物理治疗器械”,预期用途的变动比较大,从【用于面部、体部、颈部等非创伤性浅表治疗。】,更新为【用于治疗皮肤松弛,减轻皮肤皱纹,收缩毛孔,紧致、提升皮肤组织,或者治疗痤疮、瘢痕,或者减少脂肪(脂肪软化或分解)等。】;品名举例中包括“射频治疗仪、射频皮肤治疗仪”,管理类别按Ⅲ类监管。
作为这次《调整》中唯一一个有两年过渡期的产品种类,射频仪器为何被“厚爱”?
射频仪器和水光针产品不一样,它不是一款一次性的产品,不出意外的话,一款仪器可以用到一家机构倒闭。那么问题又来了,自2024年4月1日以后,没证的射频治疗仪不能卖了,那这两年是可以继续卖的?如果两年后仪器品牌拿到了械Ⅲ类批号,那之前的器械是不是可以被“一视同仁”?如果到期拿不到械Ⅲ类批号,之前的产品是否都按违规处理?
对于这些问题,相信大多数人都没有答案,监管部门目前也没有正面的指示。但是不管是水光针还是射频仪器,还是《附件》中的其他品类,这种变动不管有没有缓冲期都存在这样一个难点,对于监管部门来说也是难题。“一刀切”伤害市场,“放任不管”伤害用户,最后还会伤害市场、伤害行业。
透过现象看本质,这次的监管调整也释放出一个信号,2022年,国家对医美行业的监管会集中在产品端。回顾2021年各部门发布的监管条令,很明显监管重点在广告营销方面,2022年的监管就有可能是在更细分化的产品层面。
广告营销方面的政策是容易制定的,只是执行过程中工作量比较大;而产品的监管在划分、审批以及政策制定上都需要更专业、更细分,一旦合理的政策被制定,在执行中是会相对简单的。
但不管怎样,政策终要出手,行业也终要回归医疗本质。作为业内人也作为消费者,既希望市场保持足够的活跃,同时也希望产品的安全合规得到保障。
![]()
下载医美查APP
了解更多信息