监管 | 国家药监局:《重组人源化胶原蛋白》医疗器械行业标准立项
2022年4月24日,国家药监局发布通知,批准《重组人源化胶原蛋白》医疗器械行业标准制修订项目立项,并要求相关单位采用快速程序开展标准制定。该项目归口单位为国家药监局医疗器械技术审评中心,标准制定完成后将作为推荐性行业标准发布。
重点
《通知》称,为鼓励重组人源化胶原蛋白新型生物材料研发创新,推动医疗器械产业高质量发展,结合产业发展和监管工作需要,经研究,国家药监局批准《重组人源化胶原蛋白》医疗器械行业标准制修订项目立项。
根据2021年3月15日,国家药监局发布的《重组胶原蛋白生物材料命名指导原则》(2021年第21号通告),重组胶原蛋白分为重组人胶原蛋白、重组人源化胶原蛋白、重组类胶原蛋白三类,可制成溶液、冻干粉、凝胶等多种剂型的产品。其中,其标准制定即将立项的重组人源化胶原蛋白是指由DNA重组技术制备的人胶原蛋白特定型别基因编码的全长或部分氨基酸序列片段,或是含人胶原蛋白功能片段的组合。
据了解,由于生物合成技术水平受限,目前市场上未出现重组人胶原蛋白,只有重组人源化胶原蛋白和重组类胶原蛋白两类产品。
2021年6月29日,国家药监局发布消息显示,山西锦波生物医药股份有限公司“重组Ⅲ型人源化胶原蛋白冻干纤维”获批上市, 该产品用于面部真皮组织填充以纠正额部动力性皱纹(包括眉间纹、额头纹和鱼尾纹),是我国自主研制的首采用新型生物材料——重组人源化胶原蛋白制备的医疗器械。
国家药监局表示,该产品所使用重组Ⅲ型人源化胶原蛋白具有以下特点:一是其氨基酸序列的重复单元与人胶原蛋白氨基酸序列特定功能区相同,生物相容性好;二是其功能区域具有164.88°柔性三螺旋结构,相关结构数据已被国际蛋白结构数据库收录;三是其具有高于人体I型和Ⅲ型胶原蛋白的细胞粘附性,形成了网状纤维结构,具有良好的修复特性,预计在血管内皮、子宫内膜、创面、口腔黏膜修复及骨科等领域具有更广阔的临床应用。
关于《重组人源化胶原蛋白》医疗器械行业标准立项的通知
药监综械注〔2022〕44号
器械标管中心、器审中心:
为鼓励重组人源化胶原蛋白新型生物材料研发创新,推动医疗器械产业高质量发展,结合产业发展和监管工作需要,经研究,国家药监局批准《重组人源化胶原蛋白》医疗器械行业标准制修订项目立项。
请按照《医疗器械标准制修订工作管理规范》有关要求,采用快速程序开展标准制订,组织做好标准的起草、验证、征求意见和技术审查等工作,保证标准质量和水平。
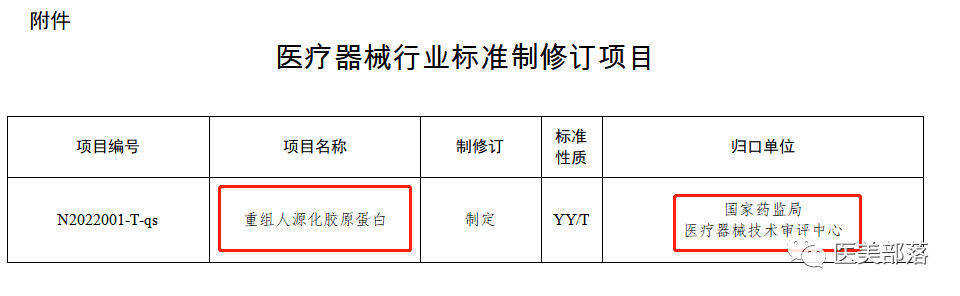
附件:医疗器械行业标准制修订项目
国家药监局综合司
2022年4月22日
下载医美查APP
了解更多信息







